Die in der Chemie übliche Bezeichnung Stoffmenge wurde in der DDR als „physikalische Größe“ geführt:
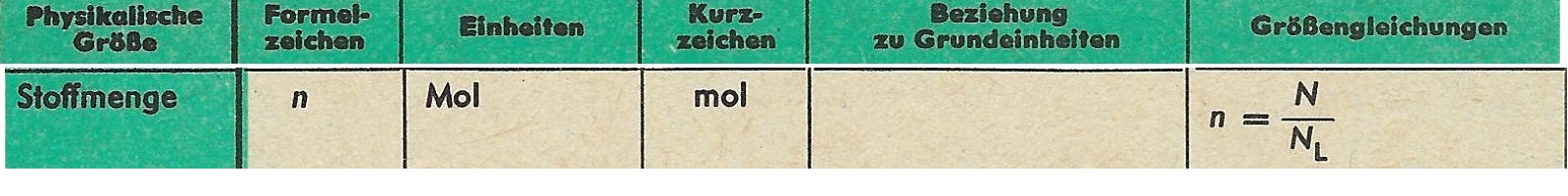
Quelle: Tabellen und Formeln, 1973, S.57
Im Westen wird das Mol sogar als Basiseinheit des Internationalen SI-Systems geführt:

Quelle: Tafelwerk, 2001, S. 41
Wo liegt der Haken?
Eine Stoffmenge ist eine reale Menge (z.B. 12 g Kohlenstoff) und kann deshalb keine Größe sein! Es ist damit unter keinen Umständen eine physikalische Größe! Die in der DDR verwendete Definition ist also falsch. Auch im Westen wird das Mol unter Größen und Einheiten geführt, was auch hier nicht sein kann.
Schauen wir uns aber einmal die West-Definition an, die ich zunächst ein wenig umformulieren möchte: „Ein Mol ist die Menge eines Stoffes, …“. Ein Mol ist also eine Bezeichnung für reale Menge und kann damit keine Größe / Eigenschaft sein! Fahren wir fort: „Diese Menge Stoff besteht aus soviel Einzelteilen, wie auch in 12 g Kohlenstoff enthalten sind.“ An einer anderen Stelle erfahren wir, daß in 12 g Kohlenstoff 6,023 mal 10 hoch 23 Kohlenstoffatome (die sogenannten Einzelteile) enthalten sind. Diese reale Menge Kohlenstoff wird als 1 Mol Kohlenstoff bezeichnet. In ein Mol Wasser sind dann also 6,023 mal 10 hoch 23 Moleküle H2O (Einzelteile des Stoffs Wasser) enthalten, die zusammen 18 g wiegen.
Die Verwirrung entsteht deshalb, weil nicht zwischen Mol (Stoffmenge) und mol (Zahl) unterschieden wird!
Mit 1 Mol Kohlenstoff meinen wir eine bestimmte (reale) Menge des Elements Kohlenstoff.
Mit 1 mol Kohlenstoff meinen wir 6,023 * 10 hoch 23 Kohlenstoffatome, wo jedes einzelne Atom ja auch Kohlenstoff heißt (siehe Periodensystem der Elemente).
1 mol ist also eine Bezeichnung für die Zahl 6,023 * 10 hoch 23. Diese wird auch als Loschmidt-Konstante bezeichnet, für die auch das Kurzeichen NL verwendet wird.
Wir können also schreiben: 1 mol = 6,023 * 10 hoch 23 = Loschmidt-Konstante = NL. Das paßt!
Bei der Bezeichnung einer Stoffmenge Mol muß aber immer mit angeben, um welchen Stoff es sich handelt, da man bei der alleinigen Angabe 1 Mol nicht weiß, ob es sich um Kohlenstoff, Wasser, Eisen oder, oder, oder … handelt.
Beispiel
1 Mol Wasser ist eine Menge Wasser, in dem 6,023 * 10 hoch 23 Moleküle H2O enthalten sind. Für die Stoffmenge 1 Mol Wasser können wir also auch 1 mol Wassermoleküle schreiben. Da ein einzelnes Wassermolekül H2O auch Wasser ist, wird aus 1 mol Wassermoleküle 1 mol Wasser, was wieder verdammt ähnlich wie die Bezeichnung für die Stoffmenge 1 Mol Wasser aussieht.
Also bitte immer schön zwischen Zahlen und realen Mengen unterscheiden!


